双光子激发荧光的优势就是相比共聚焦使用更长的波长,所以对于组织而言有着更小的伤害,同时,穿透力更深!共聚焦的成像深度普遍在100μm,而双光子可以达到250μm-500μm,有些甚至能够达到1mm。另外,同时吸收双光子仅仅在一个焦点处,所以不会损伤焦平面以外的组织,并且成像更清晰!
更短的脉冲会产生更亮的信号
多光子和高次谐波等非线性依赖于脉冲激光峰值功率。峰值功率的提高,增加了同时发生多光子吸收的概率。例如双光子荧光与三光子荧光信号分别与入射光强度的平方和三次方成比例。对于激光器峰值功率的增加,相应的激发荧光信号随之增加。低于50fs的脉冲宽度能够明显提高多光子效率和高次谐波产生效率,进而明显提高成像质量(亮度)。如下图所示,展示了双光子(SHG)和三光子(THG)信号强度与脉冲持续时间[1,2](SHG强度-1/τ)之间的关系。
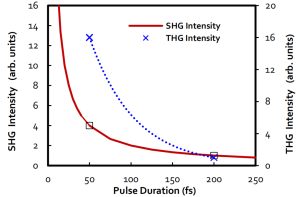
值得一提的是,如果显微镜光学器件中的色散没有得到适当补偿,脉冲将被拉伸,并且将在样品处测量较低的峰值功率。在这种情况下,脉冲持续时间和高次谐波产生效率之间的关系无法通过实验精确验证。为了产生足够的非线性SHG和THG信号,以在对样本温和的平均功率水平下实现所需的信噪比,50 fs以下的脉冲和色散预补偿的使用是必不可少的。
50fs光纤飞秒激光器——VALO系列
双光子吸收和频产生非线性过程,这要求及其强的电场强度,而电场取决于聚焦光斑的大小和激光器脉宽。聚焦光斑越小、脉宽越窄、双光子吸收效率越高!
基于光纤激光器——VALO,其具有灵活性、易用性和低维护成本。是现代双光子成像领域得力光源!紧凑型VALO Aalto和VALO Tidal激光器以30MHz的重复频率提供<50fs的脉冲,单脉冲能量分别是6.6nJ与66nJ,平均功率分别为200mW与2000mW。光束质量无对准的高质量光束(Aalto的典型M2<1.1,Tidal的典型M2<1.2)并且集成了色散预补偿模块。

VALO飞秒激光器采用被动冷却方式、不需要水冷与风冷散热。并且前面提及,超短脉冲和更好的光束质量,可以拥有更高的光子转换效率、并且较低的平均功率对于观察活体细胞而言,对细胞或组织的损伤更低。
VALO系列飞秒光纤激光器
<50 fs 脉冲持续时间
高达 2 W 的输出功率
极低的噪音
集成预补偿色散模块
应用实例1
长时间观察活体细胞过程中,光损伤是限制因素之一。在实验过程中高平均功率的持续照射对细胞本身产生很大影响。不过,对光毒性敏感的活细胞来说,低平均功率、小于50fs的脉冲宽度、极高的峰值功率,既减少了对细胞的损伤、又大大延长了成像时间。
例如下表统计所示:VALO 50fs与传统200fs进行比较,同峰值功率只需要输出1/4的激光功率,换句话来讲,成像相同质量情况下,成像效率是传统200fs激光光源的4倍!同时,相比传统200fs而言,还能拥有更长的成像时间,为了降低光毒性的影响,更低的重复频率光源是首选。总的来说,VALO激光器具备这样的优势条件。
| 脉冲宽度 | 峰值功率(30MHz) | 平均功率 |
| 200fs | 16KW | 100mW |
| 50fs | 16KW | 25mW |
VALO激光器与传统激光器参数对比
下图显示了使用VALO系列<50fs脉冲激光器在没有组织损伤的情况下进行髓鞘形态的多光子成像和长时间延时采集(超过一小时)。观察到脱轴和脱轴髓鞘膜可以研究钠离子通道在多发性硬化(MS)疾病中的作用。
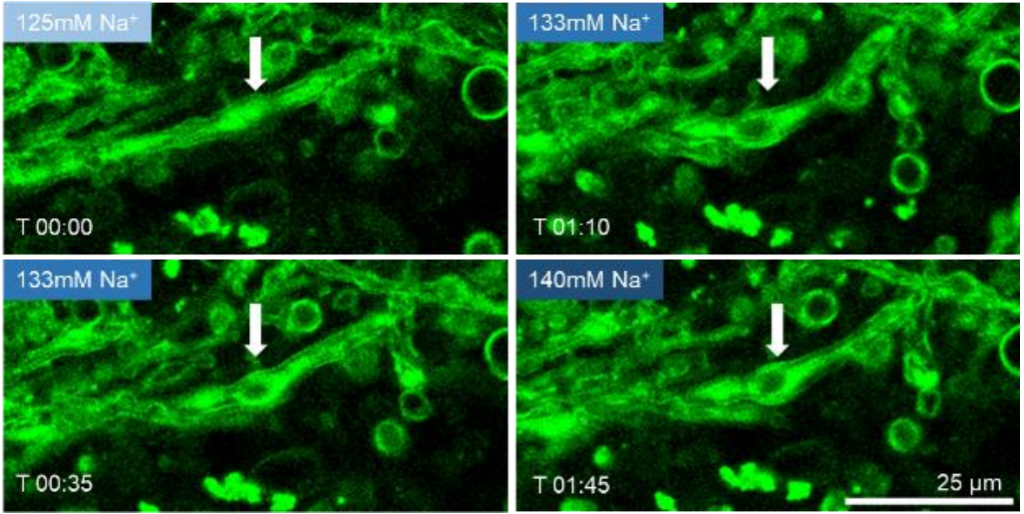
随着钠离子浓度持续提高,进而诱导髓鞘肿胀 得到的延时成像
应用实例2
如下图所示,显示了来自校准网格的三次谐波信号,样品的平均功率为4.7mW,具有VALO系列飞秒激光器的全带宽,产生约40fs脉冲。在图b)中,激光器的光谱带宽被限制在1064nm附近的10nm FWHM,产生约160 fs的脉冲。图a)和图b)中的图像具有相同的比例,但图b)中没有显示THG信号。只有在从较长的~160fs脉冲中重新缩放较低的THG信号后,才有可能获得高于实验噪声基底的图像,如图c)所示。在这种情况下,需要高2.5倍的平均激光功率来实现与从较短的50 fs以下脉冲获得的THG信号的信噪比相当的信噪比来实现。总之,小于50fs脉冲提供了相当高的脉冲峰值功率,这导致了在低得多的平均功率下的最佳信噪比图像,这反过来减少了光漂白,并延长了细胞活力。

50μm2的校准网格(ibidi) 的三次谐波。
a)47mW,全谱短脉冲 (<50fs;VALO系列)
b)6mW 光光谱限制在10nm带宽 (~160fs)
c)6mw的激光光谱限制在10nm带宽(~160fs)
展望
多光子显微镜在各种应用中具有巨大的潜力,包括开发未来的诊断筛查系统。VALO系列飞秒激光器在50 fs以下范围内提供脉冲,并提供前所未有的多光子转换效率和强大的峰值功率。这反过来又有助于推动无标签多光子应用的前沿,特别是在三次谐波成像中,因为它能够实现高灵敏度的扩展活细胞成像和延时测量。
参考文献
[1] Shuo Tang, Tatiana Krasieva, Zhongping Chen, Gabriel Tempea, Bruce Tromberg (2006), Effect of pulse duration on two-photon excited fluorescence and second harmonic generation in nonlinear optical
microscopy, Journal of Biomedical Optics, 11(2).
[2] Mira Sibai, Hussein Mehidine, Fanny Poulon, Ali Ibrahim, M. Juchaux, J. Pallud, A. Kudlinski, Darine Haidar (2018), The Impact of Compressed Femtosecond Laser Pulse Durations on Neuronal Tissue Used for Two-
Photon Excitation Through an Endoscope, Scientific Reports, 8:11124.
[3] G.M Hale and M. R. Querry (1973), Optical Constants of Water in the 200-nm to 200-microm Wavelength Region, Appl. Opt., 12, 555-563.
[4] Gert-Jan Bakker, Sarah Weischer , Júlia Ferrer Ortas, Judith Heidelin, Volker Andresen, Marcus Beutler, Peter Friedl (2022), Intravital Deep-Tumor Single-Beam 2-, 3- and 4-Photon Microscopy, eLife 11.
[5] K. Giering , O. Minet , I. Lamprecht , G. Müller (1995), Review of thermal properties of biological tissues, SPIE PM, 25, 45-65.
[6] Stephen A. Boppart, Sixian You, Lianhuang Li, Jianxin Chen, and Haohua Tu (2019), Simultaneous label-free utofluorescence-multiharmonic microscopy and beyond, cAPL Photon 4.

