Bigger and Better Photons: The Road to Great FLIM Results
原文链接 by Wolfgang Becker
翻译 by 谭瓅
摘要:这篇文章试图帮助bh FLIM技术的现有和未来用户从FLIM实验中获得最佳结果。第一部分解释了TCSPC FLIM的原理,并给出了记录的光子分布的效果。它表明,测量寿命的信噪比在优先取决于记录的光子数量。第二部分重点介绍优化光子数,而不增加施加到样品中的光应力。我们讨论了激发功率、采集时间、采集效率、数值孔径、聚焦精度、对准精度和探测器效率的影响。第三部分将重点介绍光子效率。它考虑了TCSPC计时参数、计数背景、像素数、仪器响应函数的影响,以及多指数衰减函数的挑战。最后一部分专门介绍数据分析。本文中的所有结论均通过在实际条件下记录的真实测量数据进行演示。
第二部分:优化(增加)光子数
激发功率
当FLIM用户希望增加光子数时,第一个想法通常是增加激发功率。这当然是获得更多光子的有效方法,但它并不总是有助于获得更好的FLIM结果。FLIM实验通常在荧光团浓度低的样品上进行,原因是只有当荧光团本身对细胞的活力或其代谢功能没有明显影响时,才能看到分子效应。此外,荧光团可能具有较低的量子效率。如果增加激发功率,分子必须执行更多的激发–发射循环,结果是光漂白,形成自由基,激光诱导寿命变化,光损伤,甚至样品完全被破坏。然后,成像过程不再是非侵入性的,FLIM结果变得毫无意义。因此,增加激光功率的选择是有限的(参考文献[8])。侵入性效应的几个例子如图8所示。
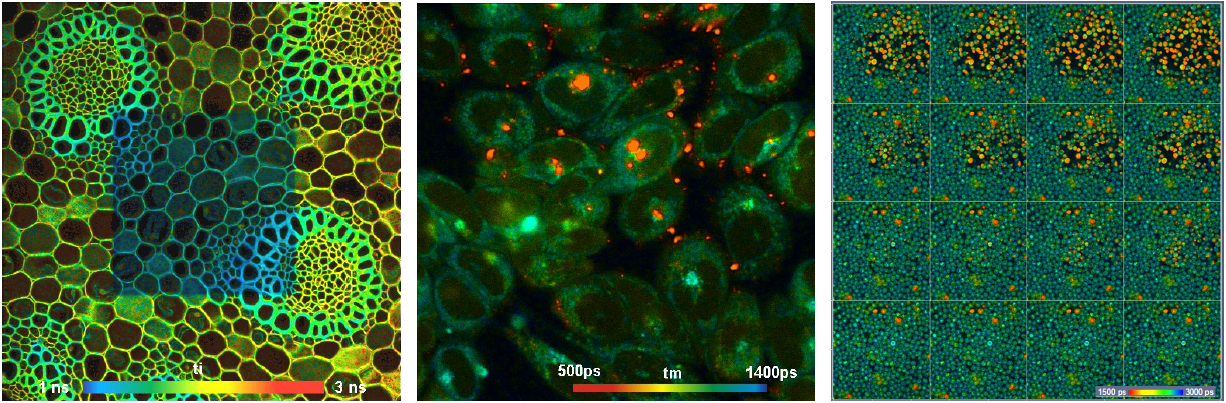
图8:左:Convallaria图像,用405nm激光扫描的中心区域。中:活细胞的双光子NADH图像。在明亮的红色斑点中,发生了光损伤,通过非常快速衰减的斑点表现出来。右图:酵母细胞的时域马赛克拼接FLIM图像,采用780nm双光子激发。记录从左下角开始,一直到拼接图的右上角。破坏从第8和9格开始,一直持续到第16格。
采集时间
与增加激发功率不同,增加采集时间通常是一种不错的选择,损伤效果是高度非线性的。通常,可以用仅略低于损伤阈值的功率长时间扫描样品,可增加光子数,所需要的只是实验者的耐心。图 9 显示了一个示例。左边的图像采集时间为1分钟,右边的图像采集时间为2分钟。结果是,右边的图像包含2倍以上的光子。正如预期的那样,它还提供了1.4倍的寿命SNR,参考图像下方的寿命直方图。
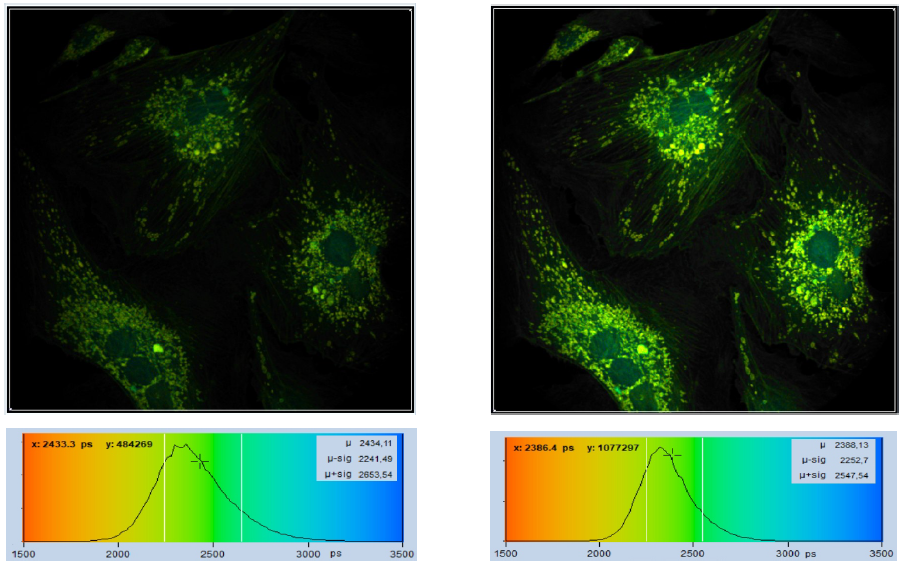
图9:以不同的采集时间对同一样品进行成像,左图 1 分钟,右图2 分钟。图像格式512×512像素,1024个时间通道。
虽然光子数(以及寿命精度)和采集时间的相关性是微不足道的,但FLIM用户通常不会意识到这一点。特别是来自传统基于强度的成像的用户,当达到强度图像的合理SNR时,往往会停止采集。但是,这存在一个谬误。当强度图像每像素包含不超过几十个光子时,它开始看起来不错。这种图像的SNR可能足以区分不同的荧光团,但不足以从荧光寿命中得出所需的分子信息。因此,请确保采集时间足够长。我们的SPCM采集软件提供了许多选项,用于在采集过程中查看光子数。您可以在所选像素或感兴趣区域中显示衰减曲线,可以在最亮的像素和所选像素中显示光子数,并且可以在线显示寿命图像。请参见图 10,使用这些选项,您应该能确定到目前为止记录的数据是否足以进行进一步分析。如有不够,请记录更长时间。
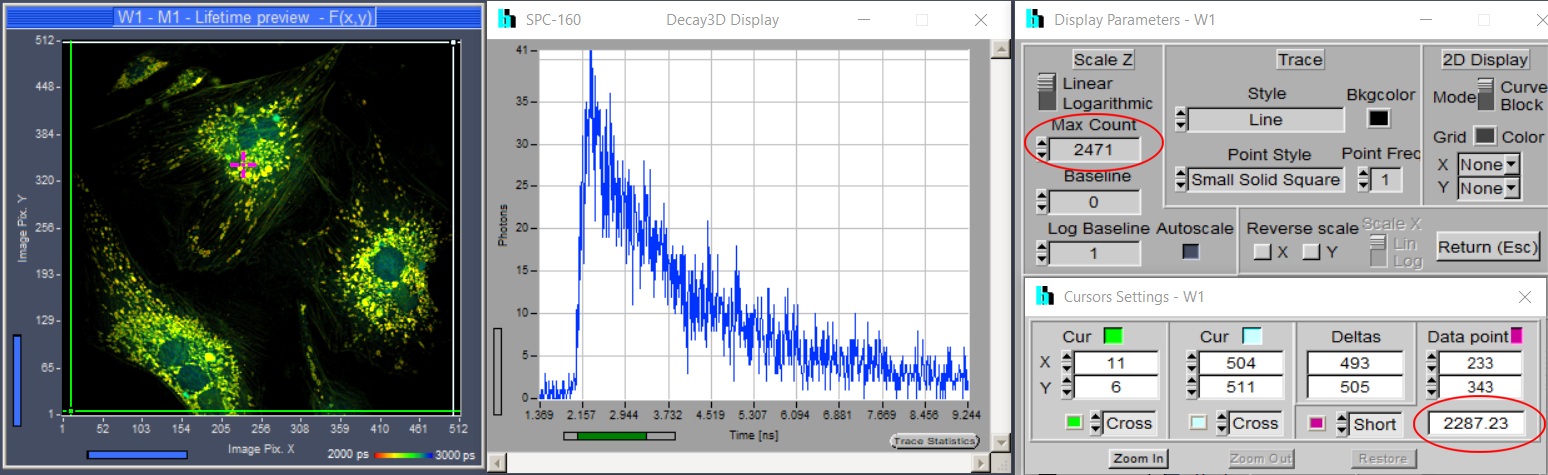
图10:SPCM帮助用户确定是否记录了足够光子数的功能。从左到右:在线寿命图像,选定位置的衰减曲线,最亮像素(顶部)中的光子数和数据点位置的光子数。
有时有人反对说,当要观察生理变化时,无法采用较长的采集时间。然而,如果使用适当的多维TCSPC技术,这并不一定,请看(参考文献[2,9])。
显微物镜
显微镜物镜的数值孔径对探测效率有显著影响。荧光以各向同性方式发射,只有一部分被显微物镜收集。从理论上讲,收集效率随着数值孔径的增加而成平方倍增加。这意味着NA 1.25的物镜应该比NA 0.5的物镜收集6倍以上的光子数。但在实践中,差异会小一些,因为高数值孔径物镜具有更多的光学元件和更低的透过率。然而,收集效率的差异是惊人的。图 11 显示了一个示例。两幅图像都采用单光子激发和共聚焦探测记录的。左图像用NA 0.5的x20空气镜记录,右图像用NA 1.25的x63油镜记录。使用高数值孔径物镜记录的图像包含的光子是低数值孔径下记录的图像的三倍。
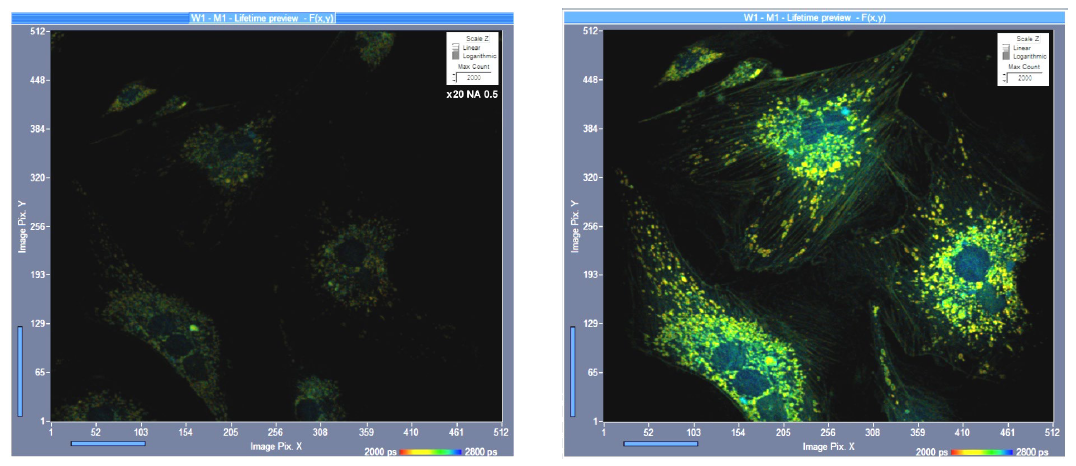
图11:使用不同NA的物镜记录的FLIM图像,相同的强度尺度,单光子激发,共聚焦探测。左:X20 空气镜,NA 0.5,右:X63油镜,NA 1.25.
聚焦
对焦不佳通常被认为是空间分辨率欠佳的来源,同时,它对探测效率也有显著影响。图 12 显示了一个示例,两幅图像均通过共聚焦扫描记录,针孔尺寸相同,采集时间相同。左图略微失焦,尽管如此,图像清晰度只是略受损。右图完全对焦。可以很容易地看出,正确对焦的图像更亮。与失焦图像相比,光子的数量大约高出1.5倍。由于FLIM系统显示强度归一化图像(这样做是因为强度的差异可能时数量级的),因此通常不会注意到这些差异。因此,当您在“预览”模式下进行最终对焦时,请花几秒钟在关闭自动缩放功能的情况下优化对焦。
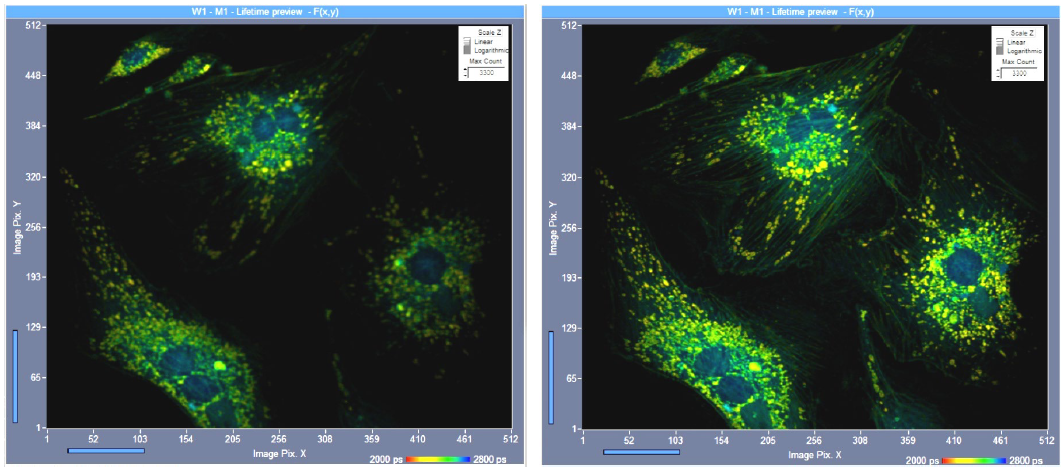
图 12:左图略微失焦,右图完全对焦。相同强度尺度,单光子激发,共聚焦探测。虽然失焦图像中的图像清晰度仅略受损,但光子数仅为完美图像中光子数的60%。图像格式512 x 512像素,1024个时间通道。
光学系统的对准
光学系统的对准对探测效率有巨大的影响,共聚焦系统尤其如此。共聚焦对准非常关键,几乎没有一个共聚焦系统可以长时间保持完美对准。图 13 显示了一个示例,左边的图像是在针孔对准稍微偏离的情况下采集的,几乎在任何共聚焦系统中都可以发现这样水平的失准。通常,它不被注意到,因为图像清晰度几乎没有受到损害。然而,与来自完美对准系统的图像进行比较(图13,右),记录的光子数量存在明显的损失。某些情况的失准甚至导致图像清晰度可见的下降,可导致光子数的巨大损失,在这些情况下,效率下降一个数量级甚至更多并不罕见。
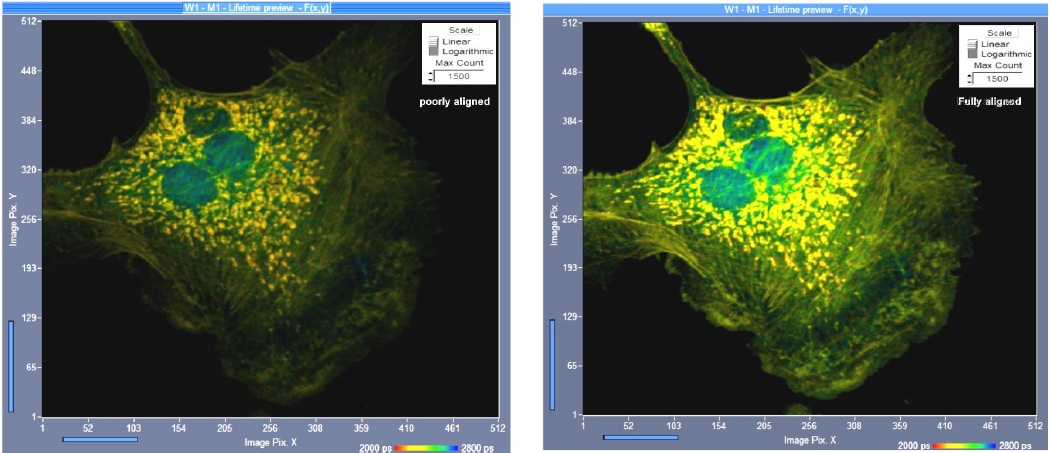
图 13:共聚焦对准的效果。左:略微失准。右:完美对准。虽然不对准尚未导致图像清晰度的可见下降,但它会导致50%的光子损失。
在非解扫探测(NDD)的多光子系统中,失准甚至也可能导致影响。虽然这些系统的探测光路很可靠,很少失准,但激发光路却存在失准的可能。多光子显微镜的飞秒激光需要空间光耦合到扫描头中,这为光路提供了许多可能偏离对准的可能,这导致激光不再集中在显微物镜的后孔径中间。结果,聚焦质量下降,激发效率降低,光漂白和光损伤并不总是以相同的比例减少,特别是如果样品在激光的本身的波长上有一定的吸收。因此,多光子系统也应该定期重新对准。这可以通过检查激光束在物镜后孔径上的位置,并将其调回中心来轻松完成。
探测器
多年来,激光扫描显微镜,特别是FLIM系统,一直使用传统的光电倍增管(PMT)作为探测器。PMT具有较大的有效面积,每平方毫米有效面积的暗计数率极低,并且有足够的增益和速度来探测单个光子。具有常规光阴极的PMT的光阴极的量子效率约为20%,然而,并非每个由阴极发射的光电子都进入放大系统并提供有用的单电子脉冲。因此,净效率约为15%。随着采用带有GaAsP阴极的PMT,效率有所提高,这些阴极的量子效率接近50%。如滨松的H7422 GaAsP PMT,已经用于FLIM多年。然而,这些探测器的仪器响应(IRF)宽度约为250至350 ps,这对于高端FLIM应用来说是不够的。随着滨松R10467-40混合型PMT的推出,情况完全改变了,混合型PMT的原理保证了几乎所有离开阴极的光电子都能提供单电子脉冲。凭借其GaAsP光电阴极,R10467-40的净探测效率达到50%。IRF快速而干净,并且没有像传统PMT那样的后脉冲背景。但R10467-40不易使用,它需要 -8000 V 和 +400 V 电源电压、可靠的过载保护、高增益前置放大器和出色的射频屏蔽。bh是第一个解决这些问题的公司,并将这种探测器完全应用到其FLIM系统(参考文献[11])。不同探测器效率的比较可以在“bh TCSPC手册”(参考文献[2])的“TCSPC探测器”一章中找到。
图 14 显示了一个实际示例。左边的图像是用传统的PMT(bh PMC-100-0模块)记录的,右边的图像是用GaAsP混合型PMT(bh HPM-100-40模块)记录的。采用GaAsP混合探测器的光子数约为4.2倍。
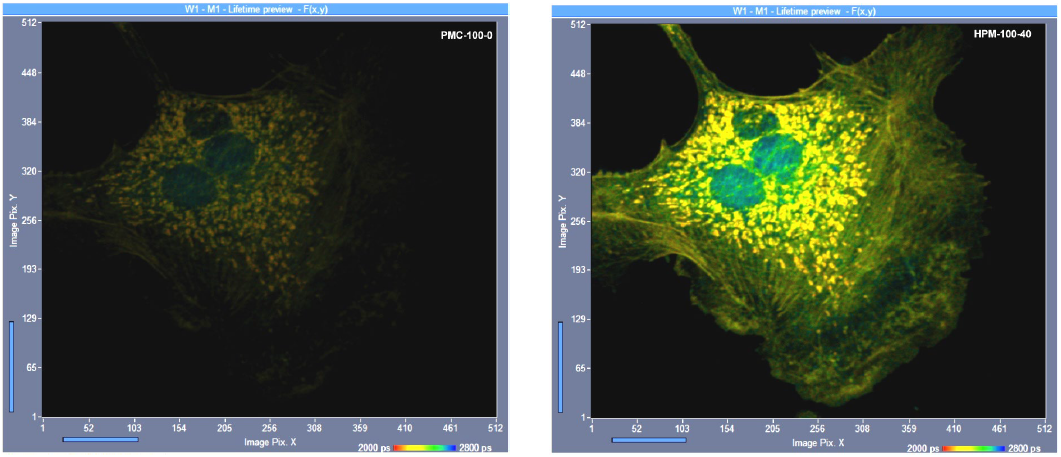
图 14:使用传统 PMT(bh PMC-100-0,左)和混合型 PMT(bh HPM-100-40,右)记录的 FLIM 图像。相同的成像条件,相同的采集时间。HPM-100-40图像包含的光子是使用传统PMT拍摄的图像的4.2倍。
像素数
获得的寿命的SNR与每个像素的光子数成正比。因此,原则上,光子限制条件下的SNR可以通过减少像素数量来增加。例如,128 x 128 像素的图像只需要 512 x 512 像素图像的 1/16 光子。这种方法的缺陷在于,它用寿命精度与空间分辨率进行了权衡。除非有其他使用低像素数的必要(例如限制的数据大小或需要快速扫描),否则不建议将像素数降低到256 x 256 以下。更好的方法是使用足够空间采样的像素数记录图像,而在数据分析中使用像素合并(参考文献[3]),有关详细信息,请参阅第四部分——“数据分析”。数据分析中的像素合并使像素数保持不变,但会对当前像素及其周围像素的衰减数据之和运行寿命分析。
其优点是空间分辨率没有损失,也没有空间欠采样,并且您可以自由地在记录的数据上选择最佳的像素合并因子。图 15 显示了一个示例。顶行的数据以128 x 128像素扫描记录,底行的数据通过512 x 512像素扫描记录,两个记录都包含相同的光子总数。因此,512 x 512 像素扫描的每像素光子数要低 16 倍。然而,较低的光子数可通过数据分析软件中的像素合并来补偿的。因此,每个合并区域(底行)的衰减曲线包含与每个像素衰减曲线(顶行)相同的光子数。因此,两个记录的寿命直方图(如右图所示)具有相同的宽度。但是,来自512 x 512像素扫描的图像(底行,左)比来自128 x 128像素扫描的图像(顶行,左)清晰得多。请参阅“数据分析”部分。
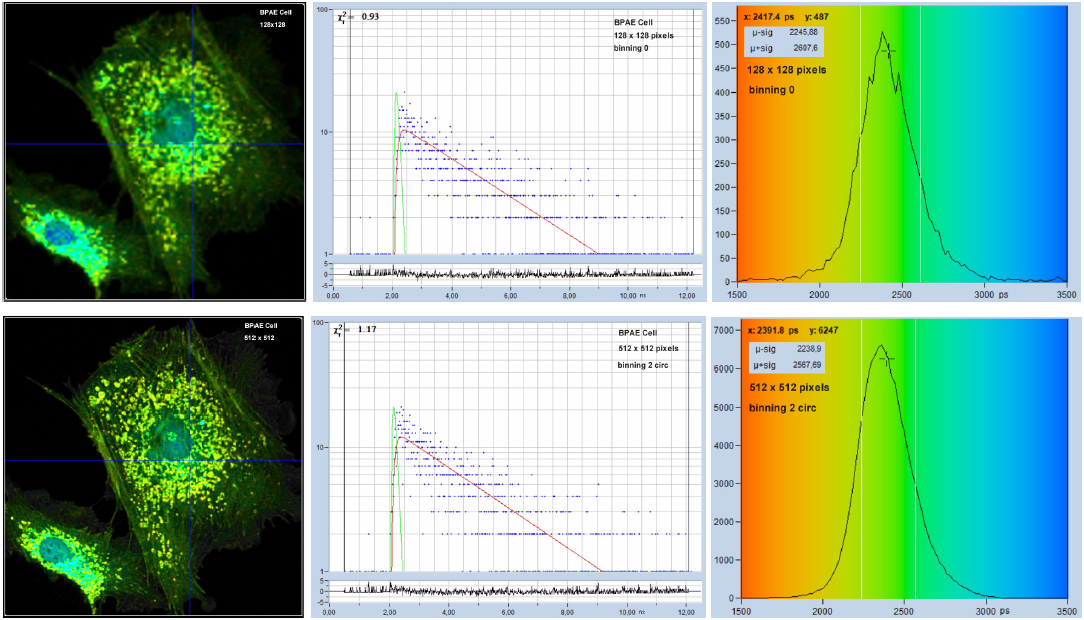
图 15:使用不同像素数记录的 FLIM 数据。相同的采集时间,相同的光子总数,上行128 x 128 像素,下行 512 x 512 像素。从左到右:图像、光标位置的衰减曲线、寿命直方图。使用像素合并对512 x 512像素的图像进行分析,以补偿每像素的较低光子数。
References
1. W. Becker, Advanced time-correlated single-photon counting techniques. Springer, Berlin, Heidelberg, New York,2005
2. W. Becker, The bh TCSPC handbook, 8th edition. Becker & Hickl GmbH (2019), available online on www.becker-hickl.com. Please contact bh for printed copies.
3. SPCImage NG data analysis software. In: W. Becker, The bh TCSPC handbook, 8th edition. Becker & Hickl GmbH(2019)
4. W. Becker (ed.), Advanced time-correlated single photon counting applications. Springer, Berlin, Heidelberg, New York (2015)
5. Becker & Hickl GmbH, DCS-120 Confocal and Multiphoton Scanning FLIM Systems, user handbook 87th ed. (2019). Available on www.becker-hickl.com
6. Becker & Hickl GmbH, Modular FLIM systems for Zeiss LSM 510 and LSM 710 family laser scanning microscopes. User handbook. Available on www.becker-hickl.com
7. Becker & Hickl GmbH, FLIM systems from Zeiss LSM 980 Laser scanning microscopes, addendum to modular FLIM systems for Zeiss LSM 510 and LSM 710 family laser scanning microscopes. Available on www.becker-hickl.com
8. Fast-Acquisition TCSPC FLIM: What are the Options? Application note, available from www.becker-hickl.com
9. W. Becker, V. Shcheslavkiy, S. Frere, I. Slutsky, Spatially Resolved Recording of Transient Fluorescence-Lifetime Effects by Line-Scanning TCSPC. Microsc. Res. Techn. 77, 216-224 (2014)
10. R.M. Ballew, J.N. Demas, An error analysis of the rapid lifetime determination method for the evaluation of single exponential decays, Anal. Chem. 61, 30 (1989)
11. W. Becker, B. Su, K. Weisshart, O. Holub, FLIM and FCS Detection in Laser-Scanning Microscopes: Increased Efficiency by GaAsP Hybrid Detectors. Micr. Res. Tech. 74, 804-811 (2011)
12. Wolfgang Becker, Cornelia Junghans, Axel Bergmann, Two-photon FLIM of mushroom spores reveals ultra-fast decay component. Application note, available on www.becker-hickl.com.
13. Becker & Hickl GmbH, Ultra-fast HPM detectors improve NADH FLIM. Application note, www.becker-hickl.com
14. Becker & Hickl GmbH, Two-Photon FLIM with a Femtosecond Fibre Laser. Application note, www.becker-hickl.com
15. Becker Wolfgang, Suarez-Ibarrola Rodrigo, Miernik Arkadiusz, Braun Lukas, Metabolic Imaging by Simultaneous FLIM of NAD(P)H and FAD. Current Directions in Biomedical Engineering 5(1), 1-3 (2019)
16. H.C. Gerritsen, M.A.H. Asselbergs, A.V. Agronskaia, W.G.J.H.M. van Sark, Fluorescence lifetime imaging in scanning microscopes: acquisition speed, photon economy and lifetime resolution, J. Microsc. 206, 218-224 (2002)
17. M. Köllner, J. Wolfrum, How many photons are necessary for fluorescence-lifetime measurements?, Phys. Chem. Lett. 200, 199-204 (1992)
18. I. Isenberg, R.D. Dyson, The analysis of fluorescence decay by a method of moments. Biophys. J. 9, 1337-1350 (1969)
